Model Atom Dalton – apa itu atom? penasaran bukan !!! tapi sebelum kita masuk kepokok pembahasan, pada pertemuan sebelumnya sudah kita bahas mengenai model atom rutherford.
Materi pembahasan kali ini mengenai model atom dalton, pengertian ciri, teori, kelebihan dan kekurangannya, untuk lebih lengkapnya simak penjelasannya di bawah ini.
Pengertian Atom
Atom ialah merupakan suatu satuan dasar materi, yang terdiri atas inti atom serta awan elektron bermuatan negatif yang mengelilinginya.Kata atom berasal dari bahasa Yunani, yaitu dari kata “Atomos” yang artinya tidak dapat dibagi-bagi.
Inti atom terdiri dari proton yang bermuatan positif, dan neutron yang bermuatan netral (kecuali pada inti atom Hidrogen-1, yang tidak mempunyai neutron). Adapun atom yang bergabung secara bersama dengan atom-atom yang lain, sehingga dapat membentuk suatu molekul.
Teori Atom Dalton
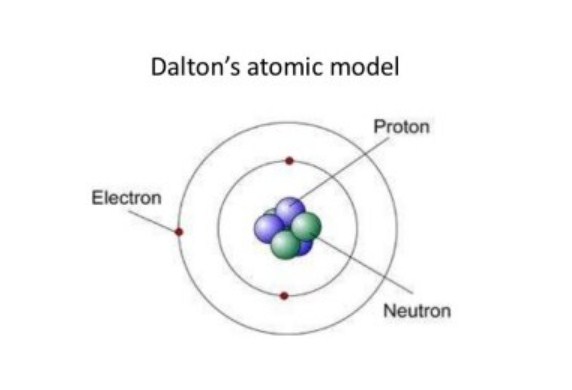
Ini merupaka suatu teori ini yang mana dikemukakan oleh John Dalton ditahun 1803 ia berpendapat berdasarkan dua hukum yang diambil, yakni hukum kekekalan massa (Lavoisier) dan hukum susunan tetap (hukum Prouts).
Lavosier menjelaskan dalam hukum kekekalan massa bahwa “massa total zat-zat sebelum reaksi sama dengan massa total zat-zat hasil reaksi”. Begitu juga dengan hukum susunan tetap.
Prouts menjelaskan bahwa “perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut, maka Dalton menarik kesimpulannya yakni :
- Jenis atom merupakan suatu bagian terkecil dalam materi yang tidak dapat dibagi lagi
- Atom berbentuk mirip seperti bola pejal yang snagat kecil, suatu atom memiliki unsur-unsur memiliki atom-atom yang identikdan berbeda dengan unsur yang berbeda
- Atom-atom yang apabila bergabung akibatnya akan membentuk sebuah senyawa dengan perbandingan suatu bilangan bulat dan sederhana.
- Reaksi kimia mempunyai fungsi untuk pemisahan dan penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Teori atom dalton tersebut menimbulkan satu kelemahan, yakni tidak bisa menjelaskan bagaimana suatu materi dapat menghantarkan listrik. Bagaimana mungkin sebuah bola pejal menghantarkan listrik, sebab listrik itu dihantarkan oleh electron yang bergerak.
Sejarah Penemuan Atom
Dalam sejarah diperkirakan penemuan atom ditemukan ditahun 1803 oleh John Dalton yang pada saat itu mengemukakan sebuah teori tentang atom.
Kemudian, banyak ilmuwan yang mendukung teori atom yang dilakukan oleh John Dalton seperti, Michael Faraday seorang yang telah menemukan teori pemecahan molekul menggunakan elektrolisis pada tahun 1832, dan J.Plucker yang menemukan tabung katoda pada tahun 1839.
Setelah itu diikuti dengan penemuan oleh Dmitri Mendelev mengenai hukum periodic pada tahun 1869. John C.Maxwell tahun 1873 yang melakukan penelitian tentang listrik dan medan listrik.
Kemudian Sir Willian Crookes pada tahun 1870 melalui penelitian eksperimental menemukan suatu electron memiliki massa tertentu melalui percobaan penembakan sinar katoda.
Lalu penelitian yang telah dilalui oleh E.Goldstein, beliau menemukan proton yang bermuatan positif.Kemudian berlanjut pada G.J Stoney yang berhasil menemukan partikel penyusun atom bermuatan negative yakni electron. Dan penelitian oleh Wilhelm Roentgen yang menemukan X-Ray.
Rutherford lalu membuat hipotesis berdasarkan penelitiannya yang mengemukakan bahwa terdapat suatu inti atom selain proton yang menjaga keseimbangan atom.
Hipotesis Rutherford tersebut kemudian dibuktikan oleh James Chadwik tahun 1932 dengan menemukan partikel atom yang bermuatan netral yang disebut dengan neutron.
Kelebihan Model Atom Dalton
- Pada Teori dalton menjadi suatu teori yang sangat penting sehingga membuat ilmuan lain tertarik untuk mempelajari atom secara mendalam, sehingga terdapat model-model atom yang lebih kompleks.
Kelemahan Model Atom Dalton
- Atom digambarkan sebagai bola pejal yang kecil
- Atom merupakan suatu partikel kecil yang tidak bisa dibagi lagi
- Atom merupakan suatu unsur yang mempunyai sifat yang sama
- Apabila atom digabungkan maka akan membentuk atom yang senyawa
- Reaksi kimia merupakan reoganisasi dari sejumlah atom, sehingga tidak ada atom yang berubah akibat reaksi kimia
Ciri-Ciri Model Atom Dalton
- Jenis atom ialah yang merupakan suatu bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
- Suatu unsur mempunyai atom-atom yang identik dan berbeda untuk unsur yang berbeda, atom dapat digambarkan menjadi bola pejal yang sangat kecil
- Dengan perbandingan bilangan bulat dan sederhana atom bergabung membentuk senyawa. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
- Pada Reaksi kimia dapat disebut juga suatu pemisahan dan penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
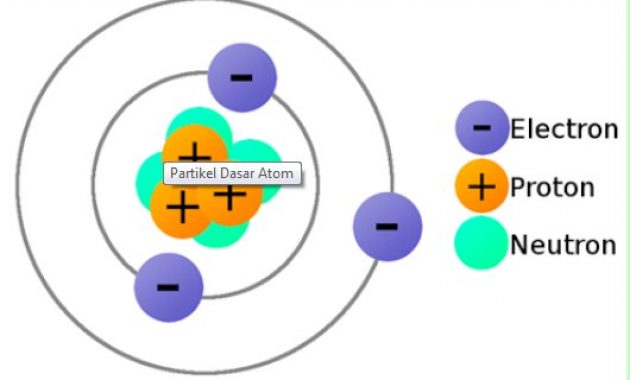
Partikel Dasar Atom
Dalam terdapat suatu Partikel yang merupakan dasar atom dan terdiri dari proton, neutron dan elektron. Partikel dasar ini tidak terlepas dari adanya pengaruh gaya elektromagnetik yang mengikat partikel-pertikel ini.
Adapun arti dari proton, neutron, dan elektron ialah, sebagai berikut.
Proton
Proton adalah partikel dasar yang mempunyai suatu muatan positif (+1) dan mempunai diameter yang hanya 1/3 diameter electron. Namun, proton memiliki massa sekitar 1840 kali electron.
Neutron
Neutron ialah merupakan suatu partikel dasar yang tidak mempunyai sebuah muatan (netral), dan mempunyai massa yang sama dengan gabungan antara massa proton dan massa electron.
Elektron
Elektron ialah masih termasuk partikel dasar yang mempunyai tapi bermuatan negative (-1) dan memiliki massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Partikel-Partikel Atom
Berikut adalah partikel-artikel atom, yakni :
Partikel Subatom
Walaupun dalam definisi atom menerangkan bahwa atom merupakan suatu bagian terkecil dari material yang tidak dapat dibagi lagi, namun dalam ilmu modern, atom sendiri tersusun dari beberapa partikel subatom. Partikel subatom tersebut meliputi proton, elektron dan neutron.
Inti Atom
Inti atom terdiri atas proton dan neutron yang terikat di inti atom oleh suatu gaya elektromagnetik. Proton dan nutron ini disebut nucleon atau penyusun inti.
Inti atom memuyai diameter sekitar 10-15 nm. dari sudut unsur kimia atom mempunyai kimia dan jumlah proton yang sama . Suatu unsur bisa mempunyai variasi jumlah neutron yang disebut isotop.
Awan Elektron
Awan partikel adalah suatu daerah dalam sumur potensi dimana tiap-tiap electron menghasilkan sejenis gelombang diam (gelombang yang tidak bergerak).
Sifat-Sifat Atom
Berikut adalah sifat-sifat atom adalah :
Sifat Nuklir
Sifat yang dimiliki oleh unsur-unsur atom yang mempunyai nomor atom lebih dari 82 ialah nuklir atau radioaktif . Dari sekitar 339 nuklida yang telah ditemukan secar alami di bumi, sebanyak 269 diantaranya belum terpantau secara menyeluruh.
Pada unsur kima, 80 dari unsur yang diketahui memiliki satu atau lebih isotope stabil. Unsur 43, 63, dan semu aunsur yang memiliki nomor atom lebih dari 82 tidak mempunyai isotope stabil. Hal ini yang menyebabkan unsur tersebut memiliki sifat radioaktif.
Massa Atom
Jumlah keseluruhan dari partikel dasar dalam suatu atom disebut nomor massa. Massa atom ialah merupakan suatu yang dalam keadaan diam dinilai dengan menggunakan satuan Dalton. Massa atom dalam unsur yang berbeda mempunyai massa yang bervariasi.
Nomor Atom
Apabila jumlah proton tidak sama dalam intinya itu merupakan Atom-atom yang ada didalam zat yang berbeda . Jumlah proton dalam inti ini disebut nomor atom.
Gaya Atom
Untuk menjaga elektron yang bermuatan negatif merupakan fungsi dari gaya elektromagnetik yang bertujuan agar tetap berada orbit sekeliling inti muatan positif.
Demikianlah materi model atom dalton, pengertian ciri, teori, kelebihan dan kekurangannya kali ini semoga artikel ini dapat bermanfaat serta dapat meningkatkan ilmu pengetahuan kita semua.
Artikel Lainnya: