Konfigurasi Elektron – Apa itu konfigurasi elelktron??nah penasaran bukan !! tapi sebelum kita masuk kepokok pembahasan, pada pertemuan sebelumnya sudah dibahas mengenai pengertian atom.
Materi kali ini akan membahas mengenai konfigurasi electron, pengertian, macam, hubungan dan contoh soalnya, untuk lebih lengkapnya simak penjelsannya berikut ini.
Pengertian Elektron
Elektron ialah merupakan suatu partikel sub-atom yang bermuatan negatif dan umumnya dapat ditulis sebagai e-. Elektron tidak memiliki komponen dasar ataupun substruktur apapun yang diketahui, sehingga ia dapat dipercayai sebagai partikel elementer. Elektron juga memiliki massa sekitar 1/1836 massa proton.
Pengertian Konfigurasi Elektron
Konfigurasi Elektron ialah merupakan suatu susunan elektron pada sebuah atom, molekul, dan struktur fisik lainnya. Sama seperti partikel elementerlainnya, elektron juga harus patuh pada hukum mekanika kuantum dan menampilkan sifat – sifat bak-partikel maupun bak-gelombang.
Macam–Macam Konfigurasi Elektron
simak sebagai berikut :
Kulit Dan Sub-kulit Dalam Konfigurasi Elektron
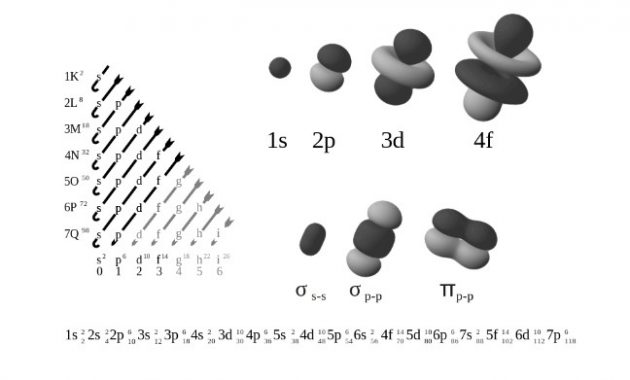
Bagian luar Sebuah kulit elektron ialah merupakan beberapa subkulit yang berbagi bilangan kuantum yang sama yaitu n (nomor sebelum angka dalam sebuah orbital). Sebuah atom dengan kulit ke-n dapat berisi 2n2 elektron.
Keberadaan Subkulit bertempat di dalam kulit yang berisikan suatu bilangan azimuth yaitu ℓ. Mempunyai nilai dari ℓ (0, 1, 2, atau 3) yang sesuai dengan tiap label s, p, d, dan f.
Elektron mempunyai Jumlah yang maksimum dan bisa ditempatkan di sebuah subkulit dirumuskan sebagai 2(2ℓ+1). Yanag terdapat Pada subkulit s dengan jumlah maksimum 2, 6 elektron pada subkulit p, 10 pada subkulit d, dan 14 pada subkulit f.
Notasi Konfigurasi Elektron
Untuk mengetahui elektron pada sebuah atom dan molekul menggunakan Notasi standar. Jika itu atom, maka notasinya terdiri dari urutan orbital atom (contoh : untuk fospor urutannya adalah 1s, 2s, 2p, 3s, 3p) dengan nomor elektron mengisi masing-masing orbital dalam format superscript.
Energi Dalam Konfigurasi Elektron
Energi juga dapat dikaitkan dengan elektron dalam orbital. Energi dalam sebuah konfigurasi sering kali mendekati jumlah energi di setiap elektron dengan mengabaikan interaksi antar elektron.
Konfigurasi yang memiliki energi terendah disebut keadaan dasar (ground state). Sedangkan konfigurasi lainnya disebut keadaan tereksitasi (excited state).
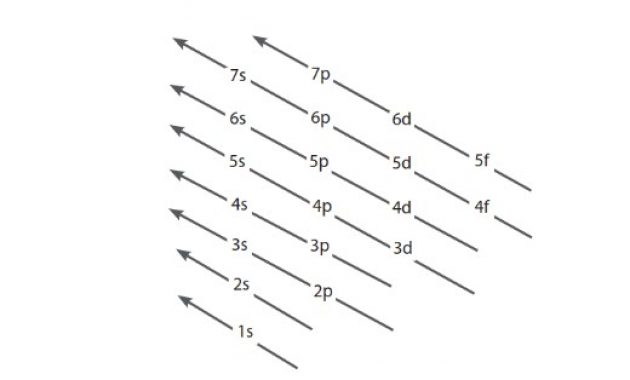
Prinsip Aufbau Dan Aturan Madelung Dalam Konfigurasi Elektron
Orbital diisi untuk meningkatkan nilai n+l.
Dimana dua orbital memiliki nilai n+l yang sama.
ini merupakan urutan orbital pada elektron :
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, (8s, 5g, 6f, 7d, 8p, dan 9s)
Penyimpangan Konfigurasi Elektron
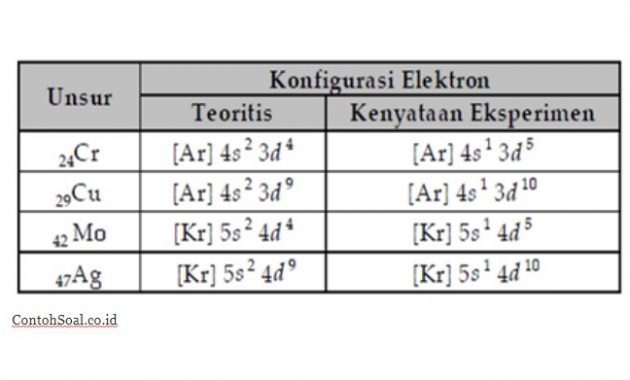
- Penyimpangan Pada Orbiital d :
Penyimpangan subkulit d yang diakibatkan oleh suatu orbital yang berisi setengah penuh (d5) atau penuh (d10) itu bersifat lebih stabil dibandingkan dengan orbital yang hampir setengah penuh (d4) atau hampir penuh (d8 atau d9).
Penyimpangan Orbital f :
Begitupun pada orbital f, Mempunyai ikata maka penyimpangan konfigurasi dalam orbital d, dan elektron yang berakhir pada orbital f juga mengalami penyimpangan.
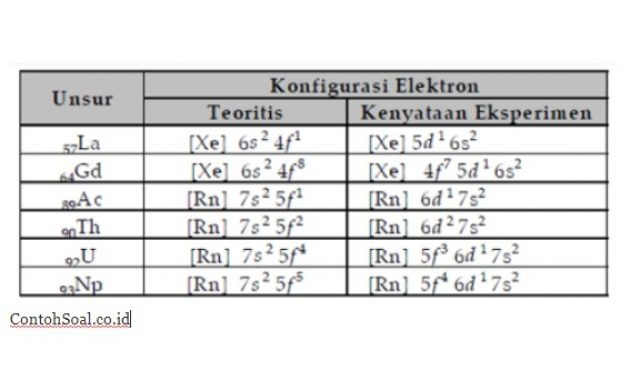
tabel orbital f
Konfigurasi Elektron Dalam Molekul
Dalam molekul, elektronnya semakin rumit. Masing-masing molekul memiliki struktur orbital yang berbeda. Orbital molekul ditandai berdasarkan simetrinya. contohnya pada bilangan O2 ditulis 1σg2 1σu2 2σg2 2σu2 3σg2 1πu4 1πg2, penyetaranya berikut ini 1σg2 1σu2 2σg2 2σu21πu4 3σg2 1πg2. Istilah berikut ini 1πg2 yang dapat mewakili dua elektron yang ada di dalam dua turunan orbital ke-π* (antibonding).
Bilangan Kuantum
Bilangan kuantum atau disebut juga kulit atom, dilambangkan dengan simbol (n) dengan n = 1, n = 2, n = 3, n = 4, n = 5, n = 6, n = 7. Untuk bilangan kuantum azimut atau sebagai subkulit atom dapat dilambangkan dengan (l).
Orbital diisi dengan maksimal 2 elektron yang memiliki bilangan spin. Jenis nomor kuantum ini berguna untuk menggambarkan energi dalam elektron. Berikut ini penjelasannya:
Nomor kuantum azimuth (l) dalam elektron menggambarkan bentuk orbitalnya. Nilai dapat memiliki bilangan bulat dari 0 hingga n-1.
Spin quantum number (s) dalam elektron menggambarkan arah putaran elektron orbital. Nilai s dapat memiliki angka +1/2 atau -1/2.
Nomor kuantum utama (n) dalam elektron mewakili level dan ukuran energi orbital. Nilai n dapat memiliki bilangan bulat positif.
Nomor kuantum magnetik (m) dalam elektron menggambarkan orientasi orbital. Nilai M dapat memiliki angka dari -1 hingga +1.
Aturan dalam konfigurasi elektron
Untuk menentukan konfigurasi elektron, tentu saja ada aturan yang harus dipenuhi. Berikut adalah beberapa aturan untuk menentukan konfigurasi elektron:
- Aturan Hund: Jika orbital memiliki tingkat energi yang sama, konfigurasi elektron mengkonsumsi energi terendah. Maka jumlah elektron yang tidak memiliki pasangan memiliki putaran paling paralel.
- Aturan build-up, di mana elektron harus berada pada tingkat energi terendah, dimulai pada 1s, 2s, 2p dll dalam urutan kulit Subc.
- Aturan Pauli, di mana dua elektron tidak berada dalam atom yang memiliki empat bilangan kuantum yang sama. Setiap orbital hanya dapat diisi dengan 2 elektron spin yang berlawanan.
Hubungan Konfigurasi Elektron Dengan Tabel Periodik

Umumnya, perioditas tabel periodik dalam blok tabel periodik bergantung pada jumlah elektron yang dapat diperlukan untuk mengisi subkulit s, p, d, dan f.
Contoh Soal
Tentukanlah nilai konfigurasi elektron dan jumlah elektron dalam kulit elektron atom unsur dibawah ini :
a. Ni (Z = 28) b. Sr(Z = 38)
Penyelesaian :
Ni (Z = 28) : 1s2 2s2 2p6 3s2 3p6 4s2 3d8 atau [Ar] 4s2 3d8; K = 2 ; L = 8 ; M = 16 ; N = 2
Sr (Z = 38) : 1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2atau [Kr] 5s2; K = 2 ; L = 8 ; M = 18 ; N = 8 ; O = 2
Demikianlah materi konfigurasi electron, pengertian, macam, hubungan dan contoh soalnya kali ini semoga artikel ini dapat bermanfaat serta dapat meningkatkan ilmu pengetahuan kita semua.
Artikel Lainnya: